 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知电对Ag++e→Ag的EΘ=+0.799V。Ag2C2O4的溶度积为5.4×10-12。试计算电对Ag2C2O4(s)+2e→2Ag+C2O2-
已知电对Ag++e→Ag的EΘ=+0.799V。Ag2C2O4的溶度积为5.4×10-12。试计算电对Ag2C2O4(s)+2e→2Ag+C2O2-的标准电极电势。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知电对Ag++e→Ag的EΘ=+0.799V。Ag2C2O4的溶度积为5.4×10-12。试计算电对Ag2C2O4(s)+2e→2Ag+C2O2-的标准电极电势。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知电对Ag++e→Ag的EΘ=+0.799V。Ag2C2O…”相关的问题
更多“已知电对Ag++e→Ag的EΘ=+0.799V。Ag2C2O…”相关的问题
已知25℃时AgBr的溶度积Ksp=4.88×10-13,EΘ(Ag+/Ag)=0.7994V,EΘ(Br2/Br-)=1.065V,试计算25℃时:(1)银-溴化银电极的标准电极电势EΘ(AgBr(s)/Ag);(2)AgBr(S)的标准生成吉布斯函数。
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm-3,将两电极组成原电池,写出原电池符号、电池反应,并求电池反应平衡常数。
已知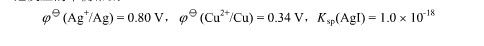
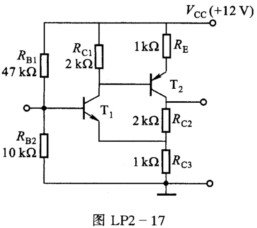
在图LP2-17所示放大电路中,已知VBE(on)1=0.7 V,VBE(on)2=-0.25 V,β1=β2=100,试求T1和T2管的集电极静态电流IC1、IC2。
计算25℃时,下列电池的电动势,并标明电池的正负极。
已知:E(AgCl/Ag)=0.222V,φSCE=0.245V
Ag,AgCl|NaCl(0.1mol·L-1),NaF(0.001mol·L-1)|LaF3单晶膜|NaF(0.1nol·L-1)‖SCE
已知:EΘ(Ag+/Ag)=0.799V,EΘ(Cu2+/Cu)=0.340V,将反应2Ag++Cu=2Ag+Cu2+组成原电池,EΘ=________V。
在298K时,下述电池的电动势E=0.1519V:
Ag(s)|AgI(s)|HI(a=1)|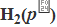 |Pt
|Pt
并已知下列物质的标准摩尔生成焓:
| 物 质 | AgI(s) | Ag+ | I- |
 | -62.38 | 105.89 | -55.94 |
试求:

计算pH=10.0,在总浓度为0.1mol·L-1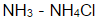 缓冲溶液中,Ag+/Ag电对的条件电势。忽略离子强度及形成
缓冲溶液中,Ag+/Ag电对的条件电势。忽略离子强度及形成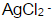 络合物的影响。(Ag-NH3络合物的lgβ1~lgβ2分别为3.24、7.05;
络合物的影响。(Ag-NH3络合物的lgβ1~lgβ2分别为3.24、7.05;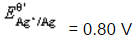 。)
。)
计算pH=10.0,总浓度为0.10mol·L-1NH3-NH4Cl缓冲溶液中Ag+/Ag电对的条件电势。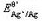 =0.80V,
=0.80V,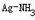 的lgβ[1=3.24,lgβ2=7.05,pKb(NH3)=4.74;忽略离子强度及形成
的lgβ[1=3.24,lgβ2=7.05,pKb(NH3)=4.74;忽略离子强度及形成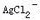 络合物的影响]
络合物的影响]
A.E1-E2
B.E1-2E2
C.E2-E1
D.2E2-E1