 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
飞灰样品制备时,首先称取一定量样品晾干至空气干燥状态,记下游离水分损失量备查,再缩分出200g试样磨细至0.2mm以下待分析。()此题为判断题(对,错)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“飞灰样品制备时,首先称取一定量样品晾干至空气干燥状态,记下游…”相关的问题
更多“飞灰样品制备时,首先称取一定量样品晾干至空气干燥状态,记下游…”相关的问题
氯化镁是重要的无机材料,在常温下易吸湿,可溶于水和乙醇。某兴趣小组以海水为原料制备无水氯化镁。
实验一制备MgCl2·6H2O晶体
以海水为原料,对其进行一系列处理,得到晶体。
(1)除去海水中不溶性杂质常用的实验操作是()(填名称)。
(2)从氯化镁溶液中析出MgCl2·6H2O晶体的结晶方法是()(填“降温结晶”或“蒸发结晶”)。
实验二样品中MgCl2·6H2O晶体含量测定
准确称取实验一制得的MgCl2·6H2O晶体ag于锥形瓶中,加去离子水溶解,依次加入一定量三乙醇胺、NH3-NH4Cl缓冲溶液,摇匀,滴入铬黑T指示剂,用0.02000mol·L-1EDTA(用H2Y2-表示)标准溶液滴定至终点,消耗EDTA溶液的体积VmL。
已知:①0.02000mol·L-1EDTA标准溶液pH约为5,指示剂铬黑T使用的适宜pH范围为8~11,NH3-NH4Cl缓冲溶液pH约为10。
②滴定原理: Mg2++H2Y2-=MgY2-+2H+。
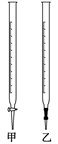
(3)使用的滴定管是()(填“甲”或“乙”)。
 (4)NH3-NH4Cl缓冲溶液的作用是()。
(4)NH3-NH4Cl缓冲溶液的作用是()。
(5)样品中MgCl2·6H2O的质量分数为()。
实验三制备无水氯化镁
利用如图实验装置(夹持和加热装置省略),准确称取一定质量MgCl2·6H2O晶体在HCl气流中小心加热。
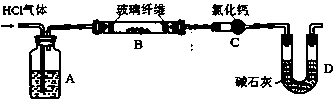 (6)A装置的作用是()。
(6)A装置的作用是()。
(7)某同学在实验前后测得玻璃管B减重m1g,干燥管C增重m2g,m1>m2,其可能的原因是()(用化学方程式表示)。
(1)HPLC条件从略。
(2)对照品溶液制备:精密称取吴茱萸碱对照品适量,加乙醇制成0.03mg/ml的溶液。
(3)供试品溶液制备:精密称取胃舒样品0.5250g,准确加入乙醇50ml,称重,超声提取30min,称重后用乙醇补足减失重量,滤过,精密量取续滤液2.5ml于10ml容量瓶中,加乙醇稀释至刻度,滤过,即得。
(4)测定法分别精密吸取对照品溶液与供试品溶液各10µl,进样测定,测得峰面积
A对=1460,A样=1520。
A.取少量溶液样品,滴入氯化钡溶液,有白色沉淀生成
B.取一定量溶液样品,滴入稀盐酸,立即有大量气体产生
C.取一定量溶液样品,滴入适量澄清石灰水,过滤,向滤液中滴加酚酞溶液,溶液变红,证明原样品中含氢氧化钠
D.向溶液样品中加入适量的澄清石灰水至恰好完全反应,过滤,可除去样品中的杂质