 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
(青浦一)常温下,经测定某溶液中的离子只有Ac-、Na+、H+、OH-四种,且离子大小的排列顺序为C(Ac-) > C(Na+) > C(H+) > C(OH-)。其可能的情况是()
A.该溶液是由pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合而成
B.该溶液是由等体积等物质的量浓度的醋酸溶液与氢氧化钠溶液混合而成
C.在上述溶液中加适量氢氧化钠,可使离子浓度大小改为:C(Ac-) > C(Na+) > C(OH-) > C(H+)
D.在上述溶液中加适量醋酸,可使离子浓度大小改为:C(Na+) > C(Ac-) > C(H+) > C(OH-)
 答案
答案
A、该溶液是由pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合而成
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“(青浦一)常温下,经测定某溶液中的离子只有Ac-、Na+、H…”相关的问题
更多“(青浦一)常温下,经测定某溶液中的离子只有Ac-、Na+、H…”相关的问题
 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。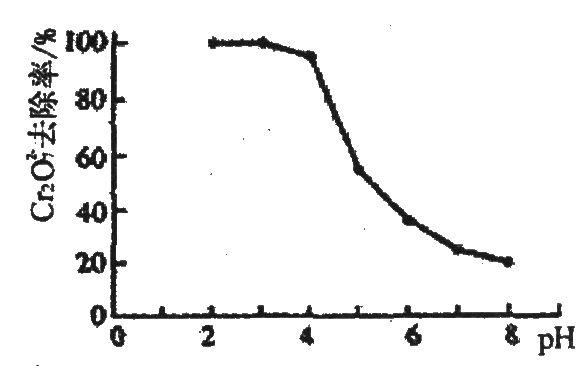
 (4)NH3-NH4Cl缓冲溶液的作用是()。
(4)NH3-NH4Cl缓冲溶液的作用是()。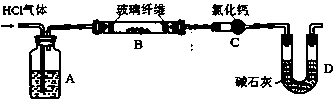 (6)A装置的作用是()。
(6)A装置的作用是()。















