 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列100kPa,298K时的热力学数据: (1)试通过热力学计算,说明下面反应298K时的进行方向:
已知下列100kPa,298K时的热力学数据:
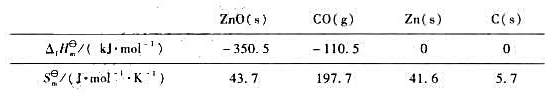
(1)试通过热力学计算,说明下面反应298K时的进行方向:
ZnO(s)+C(s)=Zn(s)+CO(g)
(2)求算上面反应自发正向进行的最低温度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列100kPa,298K时的热力学数据:
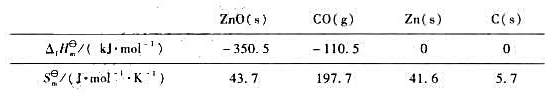
(1)试通过热力学计算,说明下面反应298K时的进行方向:
ZnO(s)+C(s)=Zn(s)+CO(g)
(2)求算上面反应自发正向进行的最低温度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知下列100kPa,298K时的热力学数据: (1)试通过…”相关的问题
更多“已知下列100kPa,298K时的热力学数据: (1)试通过…”相关的问题
(2)从书中查出上述各碳酸盐的分解温度(CdCO3为345℃),与计算结果加以比较,并加以评价.
(3)各碳酸盐分解温度的实验值与由计算结果所得出的有关碳酸盐的分解温度的规律是否一致?并从离子半径、离子电荷、离子的电子构型等因素对上述规律加以说明.
(3)分解温度的实际值和计算值的规律是一致的.金属离子的半径越小,离子所带的电荷数越大,极化能力就越强,相应碳酸盐分解温度越低;金属离子电子构型为18e的极化能力比8e的强;而极化越大,相应的碳酸盐越易分解.
已知298K时,Ca(OH)2(s)的 =-897.5kJ·mol-1,H2O(1)的
=-897.5kJ·mol-1,H2O(1)的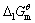 =-237.1kJ·mol-1,
=-237.1kJ·mol-1,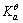 = 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
= 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
一定条件下,Ag与H2S可能发生下列反应: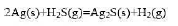 25°C,100kPa下,将Ag置于体积比为10:1的H2(g)与H2S(g)混合气体中。
25°C,100kPa下,将Ag置于体积比为10:1的H2(g)与H2S(g)混合气体中。
(1)Ag是否会发生腐蚀而生成Ag2S?
(2)混合气体中H2S气体的体积分数为多少时,Ag不会腐蚀生成Ag2S?
已知25°C时,H2S(g)和Ag2S(s)的标准生成吉布斯函数分别为-33.56kJ·mol-1和-40.26kJ·mol-1.
已知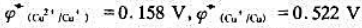 ,请计算反应2Cu+=Cu2++Cu在298K时的反应平衡常数.并由此说明+1价简单Cu+阳离子能否稳定存在于水溶液中?
,请计算反应2Cu+=Cu2++Cu在298K时的反应平衡常数.并由此说明+1价简单Cu+阳离子能否稳定存在于水溶液中?
已知电对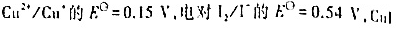 的
的
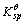 =1.3×10-12。
=1.3×10-12。
(1)试求氧化还原反应
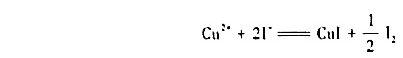
298K时的平衡常数;
(2)若溶液中Cu2+的起始浓度为0.10 mol·dm-3,I-的起始浓度为1.0 mol·dm-3,试计算达到平街时留在溶液中Cu2+的浓度。
已知在100kPa下水的凝固点为0℃,在-5℃时,过冷水的比凝固焓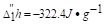 ,过冷水和冰的饱和蒸气压分别为p"(H2O,l)=0.422kPa及p"(H2O,s)=0.414kPa.今在100kPa下,有-5℃,1kg的过冷水变为同样温度、压力下的冰,设计可逆途径,分别按可逆途径计算过程的ΔS及ΔG.
,过冷水和冰的饱和蒸气压分别为p"(H2O,l)=0.422kPa及p"(H2O,s)=0.414kPa.今在100kPa下,有-5℃,1kg的过冷水变为同样温度、压力下的冰,设计可逆途径,分别按可逆途径计算过程的ΔS及ΔG.
已知25℃时Hg(l)的摩尔体积Vm=1.482x10-5m3·mol-1,体膨胀系数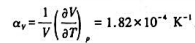 .恒温25℃时将1molHg(l)由100kPa加压到1100kPa,假设此过程Hg的体积变化可忽略不计,则过程的ΔS=()J·K-1.
.恒温25℃时将1molHg(l)由100kPa加压到1100kPa,假设此过程Hg的体积变化可忽略不计,则过程的ΔS=()J·K-1.
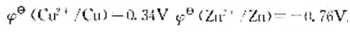 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()A.上升0.24V
B.下降0.24V
C.上升0.12V
D.下降0.12V
2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g)
根据教材附录中的数据。计算反应在298K时的标准摩尔焓变 。若反应的热能完全转化为势能, 可将100kg的重物垂直升高多少?已知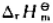 (N2H4,l)=50.63kJ·mol-1.
(N2H4,l)=50.63kJ·mol-1.