 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用四氢呋喃定容后的样品,再加入()g无水硫酸钠去除样品及溶剂中的水分,静置5min,必要时离心。
A.0.5
B.1
C.2
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.0.5
B.1
C.2
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用四氢呋喃定容后的样品,再加入()g无水硫酸钠去除样品及溶剂…”相关的问题
更多“用四氢呋喃定容后的样品,再加入()g无水硫酸钠去除样品及溶剂…”相关的问题
A.称取10.6g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容
B.定容后,塞好瓶塞,反复倒转、摇匀
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
A.称取乙二胺四乙酸(M=292.2g/mol)2.9g,溶于500mL水中
B.称取乙二胺四乙酸2.9g,加入200水溶解后,定容至500mL
C.称取二水合乙二胺四乙酸二钠盐(M=372.2g/mo1)3.7g,溶于500mL水中
D.称取二水合乙二胺四乙酸二钠盐3.7g,加入200水溶解后,定容至5mL
A.称取二水合乙二胺四乙酸二钠盐(M=372.2g/mo1)3.7g,溶于500mL水中
B.称取二水合乙二胺四乙酸二钠盐3.7g,加入200水溶解后,定容至500mL水中
C.称取二水合乙二胺四乙酸二钠盐1.9g,溶于500mL水中
D.称取二水合乙二胺四乙酸二钠盐3.722g,加入200水溶解后,定容至500mL
A.将样品配制成溶液V1 L,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测得干燥管Ⅰ增重d g
A.首先称取NaOH固体10.0 g
B.定容时仰视刻度线会使所配制的溶液浓度偏高
C.定容后将溶液摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线
D.容量瓶中原有少量蒸馏水没有影响
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a()kJ•mol-1、-bkJ•mol-1、-ckJ•mol-1;②H2O(l)=H2O(g);△H=+dkJ•mol-1
则△H1=()(用含字母a、b、c、d的代数式表示)kJ•mol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g)△H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
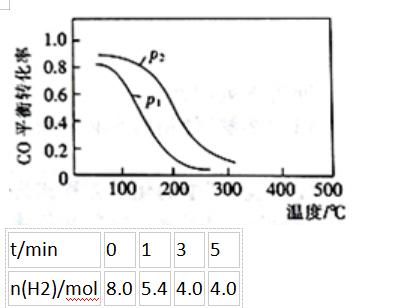 ①△H2()(填“>”“<”或“=”)0。
①△H2()(填“>”“<”或“=”)0。
②下列说法正确的是()(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=()mol•L-1·min-1。(计算结果保留两位有效数字)
④200℃时,该反应的平衡常数K=()。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡()(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6L甲烷,测得电路中转移1.2mol电子,则甲烷的利用率为()。