 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试计算在温度为27℃时,1摩尔氧分子的平均平动动能、平均转动动能和内能各是多少(把氧气当作理想气体)?
试计算在温度为27℃时,1摩尔氧分子的平均平动动能、平均转动动能和内能各是多少(把氧气当作理想气体)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试计算在温度为27℃时,1摩尔氧分子的平均平动动能、平均转动动能和内能各是多少(把氧气当作理想气体)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“试计算在温度为27℃时,1摩尔氧分子的平均平动动能、平均转动…”相关的问题
更多“试计算在温度为27℃时,1摩尔氧分子的平均平动动能、平均转动…”相关的问题
丙烷的燃烧反应方程式为
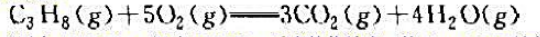
试计算在标准状态下(压力101325Pa、温度298K),反应的热效应(按1kmolC3H8计算).
某厂用一套管热交换器,每小时冷凝2000kg甲苯蒸汽,冷凝温度为110℃,甲苯的汽化潜热为363kJ/kg,其冷凝传热系 数为14000W/(m2.K).冷却水于16℃及5000kg/h的流量进入套管内管(内径为50mm)作湍流流动,其对流传热系数为 1740W/(m2.K)。水的比热可取为4.19kJ/(kg.K):(1)试计算冷却水的出口温度及套管管长。(2)由于气候变热,冷却水进口温度升 为25℃,试计算在水流量不改变的情况下,该冷凝器的生产能力的变化率。
电池Zn|ZnCl2(0.05mol·kg-1)|AgCl(s)|Ag(s)的电动势与温度的关系为E/V=1.015-4.92×10-4(R/K-298)。试计算在298K,当电池有2mol电子的电荷量输出时,电池反应的△rGm、△rHm、△rSm和此过程的可逆热效应QR。
298K时,下述电池的E为1.228V:
已知H2O(1)的标准摩尔生成焓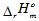 =-285.83kJ·mol-1,试求:该电池的温度系数
=-285.83kJ·mol-1,试求:该电池的温度系数
292.15K时,丁酸水溶液的表面张力可以表示为γ=γ0-aln(1+bc)。式中,γ0为纯水的表面张力;a,b皆为常数。(1)试求该溶液中丁酸的表面吸附量Γ和浓度c的关系;(2)若已知a=13.1mN·m-1;b=19.62dm3·mol-1,试计算当c=0.200mol·dm-3时的Γ为若干?(3)当丁酸的浓度足够大,达到bc>>1时,饱和吸附量Γm为若干?此时设表面上丁酸成单分子层吸附,试计算在液面上每个丁酸分子所占的截面积为若干?
A.每消耗1摩尔氧原子所消耗无机磷的摩尔数
B.测定某底物的P/O比值,可推断其偶联部位
C.每消耗1摩尔氧分子能生成的ATP的分子数
D.维生素c通过Cytc进入呼吸链,其P/O比值为2
E.每消耗1摩尔氧原子所消耗的ATP的摩尔数
试计算在101.325kPa,78℃(乙醇的沸点),1m3乙醇蒸气完全变成液体的ΔU和△H。已知乙醇的气化热为39.7kJ/mol。
在770K,100.0kPa下,反应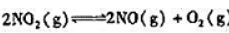 达到平衡,此时NO2的转化率为56.0%,试计算:
达到平衡,此时NO2的转化率为56.0%,试计算:
(1)该温度下反应的标准平衡常数Kθ;
(2)若要使NO2的转化率增加到80.0%,则平衡时压力为多少?