 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取某一元弱酸HB 0.8000g,溶于水后,以0.1000mol·L-1NaOH溶液滴定至终点,消耗24.60mL。当滴入NaOH溶液10.00m
称取某一元弱酸HB 0.8000g,溶于水后,以0.1000mol·L-1NaOH溶液滴定至终点,消耗24.60mL。当滴入NaOH溶液10.00mL时,溶液的pH=4.50,计算HB的摩尔质量与Ka值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取某一元弱酸HB 0.8000g,溶于水后,以0.1000mol·L-1NaOH溶液滴定至终点,消耗24.60mL。当滴入NaOH溶液10.00mL时,溶液的pH=4.50,计算HB的摩尔质量与Ka值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取某一元弱酸HB 0.8000g,溶于水后,以0.1000…”相关的问题
更多“称取某一元弱酸HB 0.8000g,溶于水后,以0.1000…”相关的问题
称取某弱酸HA试样1.0264g,溶于适量水中,以酚酞为指示剂,用0.1000mol/LNaOH滴定,当滴定剂加到10.50mL时,溶液的pH为4.20;滴定至终点时,消耗NaOH溶液24.70mL。求:

A.5.0×10-5
B.2.0×10-4
C.1.0×10-4
D.A,B,C均不对
称取仅含弱酸盐NaA和NaB的Na2CO3试样0.6125g,加水溶解后,以甲基橙为指示剂,用浓度为0.2000mol/L HCl标准溶液滴定,甲基橙变色时,消耗HCl标准溶液32.72mL;上述等量样品加水溶解后,若以酚酞为指示剂,用0.1000mol/L HCl标准溶液滴定,消耗25.34mL。(1)写出有关反应方程式;(2)各组分的质量分数是多少?(已知:弱酸HA的pKa=7.0,弱酸HB的pKa=1,MNa2CO3=105.99,MNaA=182.03,MNaB=132.0)
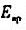 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。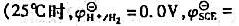
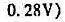
(1)每升碱液吸收了多少克CO2?
(2)用该碱液滴定某一元弱酸,若浓度仍以0.1026ml·L-1计算,会引起多大误差?
已知0.10 mol·L-1—元弱酸HB溶液的pH=3.5,则0.10 mol·L-1共轭碱NaB溶液的pH是()。
A.10.5
B.10.0
C.9
D.9.5
铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下: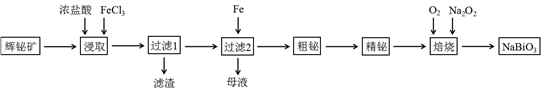 已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有()(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式()。
(2)浸取时加入过量浓盐酸的目的是()。
(3)写出焙烧时生成铋酸钠的化学方程式()。
(4)用H2Dz(双硫腙,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
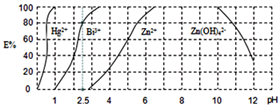 ①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
②向萃取后的CCl4中加入足量的NaOH溶液可将Bi(HDz)3中铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为()。
(5)取焙烧得到的NaBiO3样品加入稀硫酸和MnSO4溶液使其完全溶解。已知NaBiO3被还原为Bi3+,Mn2+被氧化成MnO4-,试写出该反应的离子方程式:()。
某一元弱酸HA的浓度为0.010mol·L-1,在常温下测得其pH为4.0。求该一元弱酸的解离平衡常数和解离度。
已知298K时浓度为0.010mol·L-1的某一元弱酸溶液的pH为4.00,则该酸的解离平衡常数Ksp约为______;将该溶液稀释后,其pH将变______,解离度α将变______,其将______。